
近日,yl23411永利官网登录金鑫教授和厦门大学材料学院侯振清教授课题组合作在生物材料领域国际顶级期刊《Biomaterials》(影响因子:12.479)在线刊发了题为“Aβ-responsive metformin-based supramolecular synergistic nanodrugs for Alzheimer’s disease via enhancing microglial Aβ clearance”的研究成果。该研究首次将智能响应型靶向超分子纳米双载药传输体系应用于阿尔茨海默病(Alzheimer’s disease,AD)的治疗。
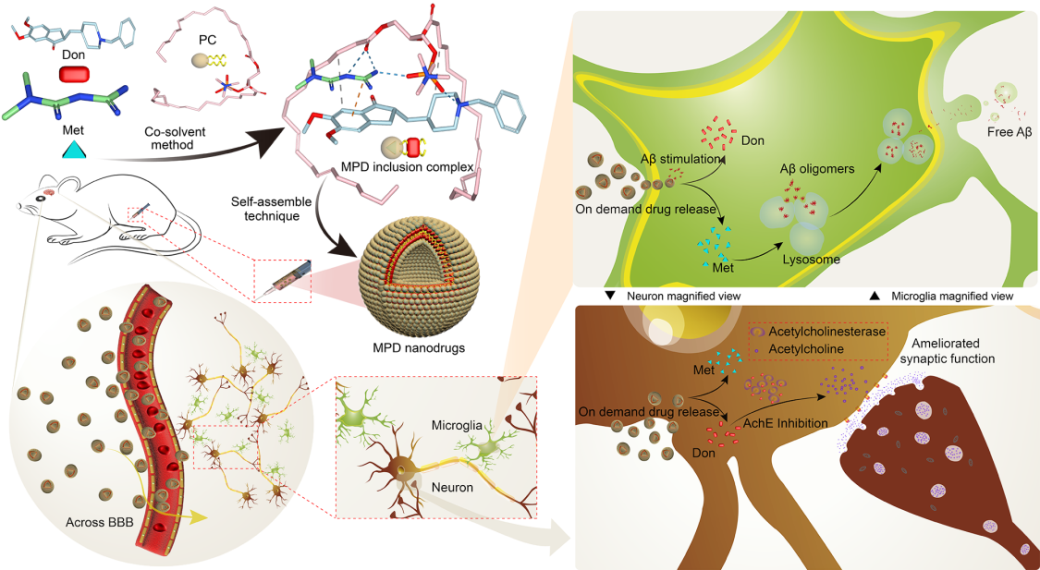
图1可渗透血脑屏障(BBB)和Aβ刺激响应的纳米双载药传输体系的构建及其治疗AD的机制示意图。
随着老龄化的加剧,全球确诊的AD患者超过5000万人,到2050年这一数字将大幅增加到1.52亿人。统计数据估计,每4秒就有1人被诊断为AD。AD病理现象复杂,AD患者普遍存在脑神经细胞外大量β-淀粉样蛋白( β-amyloid,Aβ) 沉积形成的老年斑、tau蛋白异常磷酸化形成的细胞内神经原纤维缠结( neurofibrillary tangles,NFTs) 、神经元丢失、神经营养不良、突触丢失等病理现象。
在AD新药研究中的最大瓶颈是小分子药物的选择性差或难以入脑。该研究构建的新体系不仅有效克服了临床药物治疗中枢神经系统疾病渗透血脑屏障(BBB)难、联合用药生物利用度低及效果差等不足,更有趣地是我们发现低剂量“神药”二甲双胍的引入不仅显著提升纳米双载药体系的结构稳定性,而且可通过增强小胶质细胞Aβ清除与临床抗痴呆药物多奈哌齐协同治疗AD。本研究不仅为中枢神经系统疾病的药物治疗提供了新思路和新方法,也拓宽了纳米药物传输体系在疾病诊疗方面的应用范围。另外,本研究所开发的智能响应型靶向超分子纳米双载药传输体系属改良药物剂型,极具临床转换价值,有望为改善中枢神经系统疾病提供新的临床候选药物。
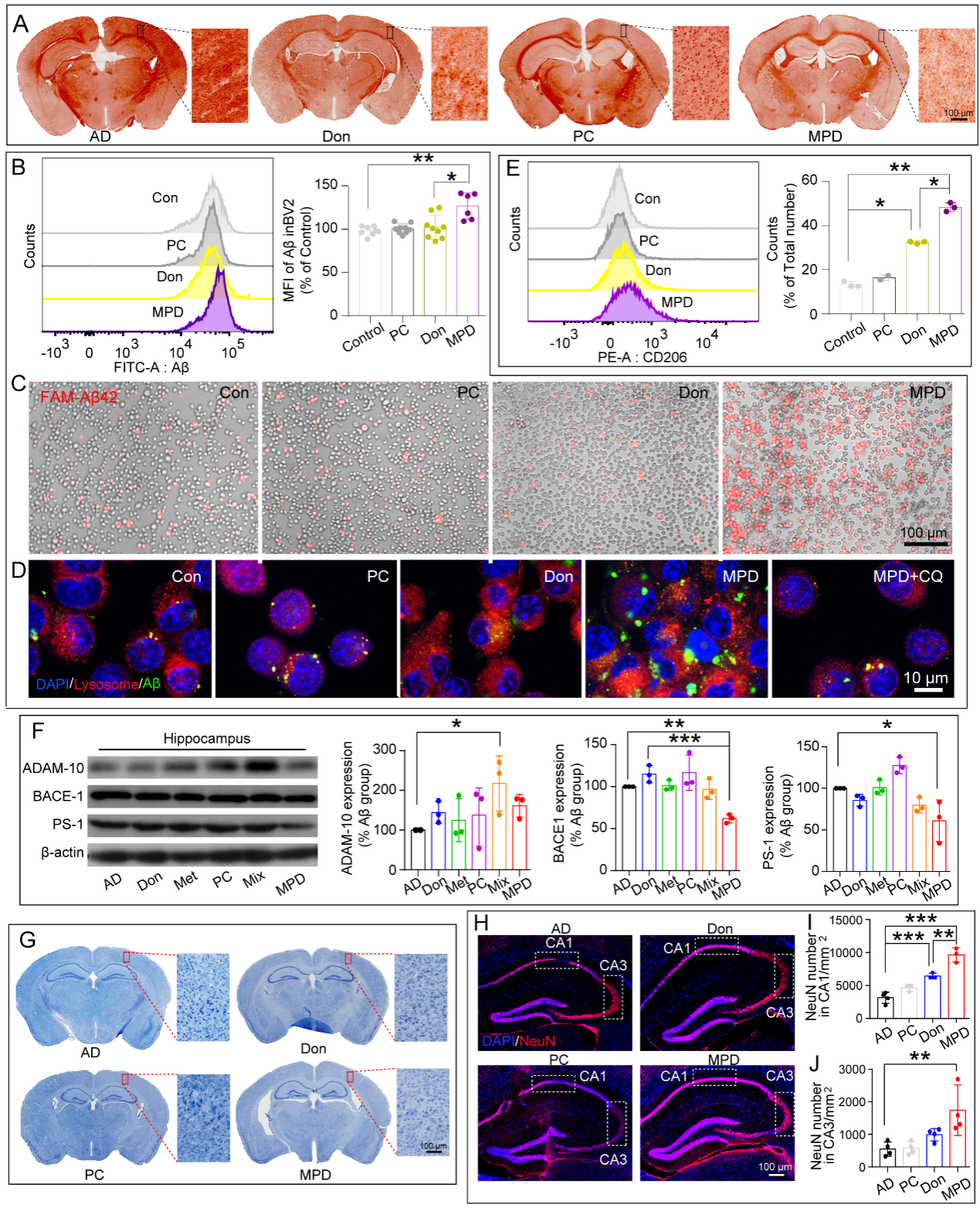
图2纳米双载药传输体系通过促进小胶质细胞Aβ吞噬改善AD小鼠模型中的神经元丢失。
我校材料学院博士研究生范仲雄、医学院博士研究生任桐、医学院硕士研究生王佑君为该论文的共同第一作者。金鑫教授课题组杨立朝老师为该论文的通讯作者。该研究得到了国家自然科学基金和厦门大学校长基金的资助和支持。另外,该研究还得到了我校材料学院侯振清教授和葛东涛教授以及我校医学院金鑫教授的大力支持和指导。
全文链接:https://doi.org/10.1016/j.biomaterials.2022.121452
(医学院)



